Derivat Asam Karboksilat
Pada pertemuan Kali ini saya akan membahas mengenai derivat asam
karboslilat.
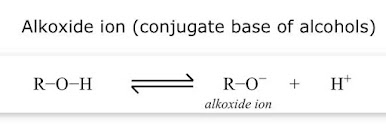
Jika gugus-gugs fungsi yang sama melekat pada gugus asil (RCO-) sifat-sifatny
secara substansial berubah, dan mereka ditetapkan sebagai turunan asam
karboksilat. Asam karboksilat memiliki gugus hidroksil yang terikat pada gugus
asil, dan turunan fungsionalnya disiapkan dengan penggantian gugus hidroksil
dengan substituen, seperti halo, alkoksil, amino, dan asiloksi.
kereaktifan
turunan asam karboksilat bergantung pada kemudahan pembentukan intermediate
tetrahedral dipengaruhi oleh dua hal yaitu :
Faktor
Sterik
Makin
banyak gugus-gugus pada C- α maka reaksi makin sulit terjadi.
Faktor
Elektronik
Mempengaruhi
polarisasi gugus C-O disebabkan oleh dua hal yaitu :
1.
Subtituen pada inti aromatis
2.
Keelektronegatifan gugus lepas Y
Reaksi Derivatif Asam Karboksilat
1.Substitusi Grup Asil
Ini mungkin reaksi paling penting dari turunan asam karboksilat. Untuk pereaksi
nukleofilik tertentu, reaksi tersebut dapat mengambil nama lain juga. Jika
Nuc-H adalah air reaksi sering disebut hidrolisis, jika Nuc-H adalah alkohol
reaksi disebut alkoholisis, dan untuk amonia dan amina disebut aminolisis.
Turunan asam karboksilat yang berbeda memiliki
reaktivitas yang sangat berbeda, asil klorida dan bromida yang paling reaktif
dan amida yang paling reaktif, seperti yang tercantum dalam daftar secara
kualitatif dibawah ini. Dalam sistem pelarut yang homogen, reaksi asil klorida
dengan air terjadi dengan cepat, dan tidak memerlukan pemanasan atau katalis.
Amida, di sisi lain, bereaksi dengan air hanya dengan adanya asam kuat atau
katalis basa dan pemanasan eksternal.
Reaktivitas: asil halida> anhidrida >> ester ≈ asam >> amida
Karena perbedaan-perbedaan ini, konversi satu jenis turunan asam menjadi yg
lain umumnya terbatas pada yang diuraikan dalam diagram berikut. preparat amida
dan anhidrida tidak umum dan memerlukan pemanasan yg kuat. Sintesis anhidrida
yang lebih baik dan lebih umum dapat dicapai dari asil klorida, dan amida mudah
dibuat dari salah satu turunan yg lebih reaktif. Asam karboksilat sendiri bukan
merupakan bagian penting dari diagram ini, meskipun semua turunan yang ditunjukkan
dapat dihidrolisis menjadi asam asam karboksilat (formula biru muda dan panah
reaksi). Hidrolisis basa yang dikatalisis menghasilkan garam karboksilat.
pembentukan ikatan terjadi sebelum pembelahan
ikatan, dan atom karbon karbonil mengalami perubahan hibridisasi dari sp2 ke
sp3 dan kembali lagii. Fasilitas yg ditambahkan pereaksi nukleofilik ke gugus
karbonil telah dicatat sebelumnyo untuk aldehida dan keton.
2.Nitril
Meskipun mereka tidak memiliki gugus karbonil, nitril sering diperlakukan
sebagai turunan dari asam karboksilat. Hidrolisis nitril menjadi asam
karboksilat membutuhkan kondisi reaksi (katalis dan panas) yang serupa dengan
yg dibutuhkan untuk menghidrolisa amida. Ini tidak mengherankan, karena
penambahan air pada ikatan rangkap karbon-nitrogen menghasilkan zat antara yang
tautomerisasi menjadii amida.
Permasalahan:
2.
Mengapa
Dalam sistem pelarut yang homogen, reaksi asil klorida dengan air terjadi dengan
cepat, dan tidak memerlukan pemanasan atau katalis?
3. Pada reaksi hidrolisis ester,ester terhidrolisis baik dalam suasana basa menghasilkan fragmen asam karboksilat dan alkohol. Bagaimana pada reaksi hidrolisis ester ini jika dilakukan dalam suasana asam? Apakah akan menghasilkan produk yang sama yaitu asam karboksilat dan alkohol?