MEKANISME REAKSI E1
Unimolecular Elimination (E1) ialah reaksi dimana penghilangan substituen HX menghasilkan pembentukan ikatan rangkap. Reaksi E1 ini sama dengan reaksi substitusi nukleofilik unimolecular (SN1) dalam berbagai cara. Salah satunya adalah pembentukan perantara karbokation. Dan juga salah satunya, tahap yang menentukan laju (lambat) adalah disosiasi kelompok yang meninggalkan untuk membentuk karbokation. Oleh karena itulah dinamakan unimolecular. Jadi, karena dua reaksi ini berperilaku sama, mereka saling bersaing. Sering kali, kedua reaksi ini akan terjadi secara bersamaan untuk membentuk produk yang berbeda dari satu reaksi. Namun, salah satunya dapat disukai lebih dari yang lain melalui kontrol termodinamika. Meskipun Eliminasi melibatkan dua jenis reaksi E1 dan E2.
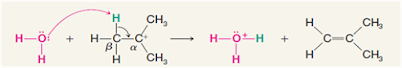
Reaksi E1 melibatkan deprotonasi hidrogen di
dekatnya (posisi beta) karbokation yang menghasilkan pembentukan produk alkena.
Seperti reaksi dibawah ini yang akan menjadikan B sebagai basis Lewis, dan LG
menjadi grup yang meninggalkan halogen.
Seperti dapat dilihat di atas, langkah awal adalah meninggalkan kelompok
(LG) sendiri. Karena kelompok (LG) membawa elektron-elektron dalam ikatan
bersamanya, karbon yang melekat padanya kehilangan elektron, menjadikannya
karbonokasi. Setelah menjadi karbokation, Basa Lewis (B−B−) mendeprotonasikan
karboksi antara pada posisi beta, yang kemudian menyumbangkan elektronnya ke
ikatan C-C yang berdekatan, membentuk ikatan rangkap. Reaksi E1 hanya
membutuhkan hidrogen tetangga. Tidak seperti reaksi E2, yang membutuhkan
proton anti terhadap kelompok yang pergi, Ini disebabkan oleh fakta bahwa
kelompok yang pergi telah meninggalkan molekul. Produk akhirnya adalah alkena
bersama dengan produk sampingan HB.
Mekanisme Reaksi E1
Dalam mekanisme reaksi E1, juga dikenal sebagai reaksi eliminasi unimolecular. Yang terdiri dari dua langkah mekanisme yaitu, ionisasi dan deprotonasi. Selama ionisasi, ada pembentukan karbokation sebagai perantara. Dalam deprotonasi, proton hilang oleh karbokation. Ini terjadi di hadapan basa yang selanjutnya mengarah pada pembentukan ikatan pi dalam molekul. Ini menunjukkan kinetika orde pertama, dengan laju reaksi yang hanya bergantung pada konsentrasi alkil halida saja. Reaksi E1 biasanya terjadi pada alkil halida tersier dan lebih cepat bereaksi dibandingkan dengan alkil halida sekunder. Tidak seperti reaksi E2, E1 tidak stereospesifik. Dengan demikian, hidrogen tidak diperlukan untuk menjadi anti-periplanar untuk kelompok yang pergi.
Contoh mekanisme reaksi E1, yaitu
Pada tahap pertama, disebut tahap ionisasi, pada reaksi diatas dibantu oleh pelarut polar,
klorin pergi dengan pasangan elektron yang mengikatnya dengan karbon.
Langkah lambat ini menghasilkan karbokation tersier dan ion
klorida yang relatif stabil. Ion-ion dilarutkan (dan distabilkan) oleh molekul
air di sekitarnya. Tahap ini juga disebut tahap lambat sebagai tahap penentu
laju dari reaksi keseluruhan.
Selanjutnya pada tahap ke-2, disebut tahap deprotonasi yaitu, Molekul
air menghilangkan salah satu hidrogen dari karbon beta dari karbokation.
Hidrogen ini bersifat asam karena muatan positif yang berdekatan. Pada saat
yang sama pasangan elektron bergerak membentuk ikatan rangkap antara atom
karbon alfa dan beta. Langkah ini menghasilkan ion alkena dan hidronium.
Permasalahan:
1. Mengapa
reaksi E1 hanya membutuhkan hydrogen tetangga bukan proton anti?
2. Dikatakan
bahwasanya reaksi SN1 dan E1 adalah reaksi bersaingan. Kondisi yang
bagaimanakah suatu reaksi E1 dapat menang bersaing dengan SN1?
3. Reaksi
eliminasi identic dengan bantuan basa, dimana pada reaksi E1 yang digunakan
adalah basa lemah, mengapa demikian dan apa pengaruhnya kekuatan basa tersebut
pada reaksi E1 ini?



Baiklah perkenalkan nama saya Zainuddin Azhim Nim A1C119007 akan mencoba menjawab permasalahan no 3
BalasHapusMenurut saya, Reaksi E1 tidak menggunakan basa kuat dikarenakan reaksi E1 ini berjalan 2 tahap yakni pelepasan gugus pergi dan penyerangan nukleofil yang bersifat lemah,oleh karena nukleofil yang di serang bersifat lemah maka basa yang di gunakan juga harus lemah, jikalau kita menggunakan basa kuat maka akan kembali menjadi reaksi E1
Terima kasih
Assalamu'alaikum warahmatullahi wabarakatuh, baik lah nama saya Sri Maryati Nim A1C119099, disini saya aka mencoba menjawab permasalahan nomor 1.
BalasHapusKarena dalam mekanisme E1, gugus keluar meninggalkan lebih dulu untuk menghasilkan karbokation, karena adanya orbital p kosong setelah lepasnya gugus pergi, hidrogen pada karbon tetangga menjadi jauh lebih asam, memungkinkannya untuk kemudian dihilangkan oleh basa lemah pada langkah kedua atau langkah selanjutnya. Berbeda dengan reaksi E2, yang membutuhkan proton anti terhadap kelompok yang pergi, Ini disebabkan oleh fakta bahwa kelompok yang pergi telah meninggalkan molekul.
Terimakasih 🙏
Baiklah saya Rizki Haryati NIM A1C119004 akan mencoba menjawab permasalahan nomor 2.
BalasHapusMenurut saya jika kita ingin E1 mendominasi di atas SN1: pilih asam dengan lawan nukleofilik yang lemah [H2SO4, TsOH, atau H3PO4],sebab merupakan nukleofil yang relatif buruk karena muatan negatif oksigen didistribusikan ke seluruh molekul (resonansi).Pada pelarut polar seperti air atau alkohol, dan dipanaskan.
Terimakasih