MEKANISME REAKSI ELIMINASI
E2
Pada pertemuan kali ini kita akan membahas
mengenai mekanisme reaksi eliminasi E2. Pada pertemuan sebelumnya kita telah
mempelajari tentang mekanisme reaksi substitusi nukleofilik SN2 dan SN1.
Sebelum melanjutkan materi mekanisme reaksi E2 lebih dalam, kita akan terlebih
dahulu memahami apa itu reaksi eliminasi itu sendiri.
Reaksi eliminasi umumnya dikenal dengan jenis
atom atau kelompok atom yang meninggalkan molekul. Penghapusan atom hidrogen
dan atom halogen, misalnya dikenal sebagai dehidrohalogenasi, ketika kedua atom
yang meninggalkannya adalah halogen, reaksinya dikenal sebagai dehalogenasi.
Demikian pula, penghapusan molekul air, biasanya dari alkohol, dikenal sebagai
dehidrasi, ketika kedua atom yang meninggalkannya adalah atom hidrogen,
reaksinya dikenal sebagai dehidrogenasi. Reaksi eliminasi juga diklasifikasikan
sebagai E1 atau E2, tergantung pada kinetika reaksi. Dalam reaksi E1, laju
reaksi sebanding dengan konsentrasi zat yang akan diubah dalam reaksi E2, laju
reaksi sebanding dengan konsentrasi substrat dan zat penghilang.
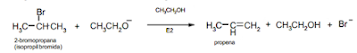
Reaksi E2
E2 menggambarkan eliminasi (E) yang memiliki
langkah menentukan tingkat bimolekuler (2) yang harus melibatkan basis.
Hilangnya kelompok yang pergi bersamaan dengan pengangkatan proton. Ada
sejumlah faktor yang mempengaruhi apakah eliminasi berjalan dengan mekanisme E1
atau E2. Hanya E2 yang dipengaruhi oleh konsentrasi basa, sehingga pada
konsentrasi basa tinggi E2 disukai. Laju reaksi E1 bahkan tidak terpengaruh
oleh basa apa yang ada, jadi E1 juga sama lemahnya dengan basa kuat, sementara
E2 lebih cepat dengan basa kuat daripada basa lemah. Basa kuat pada konsentrasi
apa pun yang lebih disukai E2 daripada E1. Jika kita melihat bahwa basa kuat
diperlukan untuk eliminasi, itu tentu termasuk reaksi E2.
Reaksi E2 berjalan tidak lewat suatu karbokation
sebagai zat antara, melainkan berupa reaksi serempak (concerted reaction)
yaitu terjadi pada satu tahap, sama seperti reaksi Sn1.
Reaksi E2 merupakan
reaksi satu tahap. Dimana dalam satu tahap tersebut terjadi 3 hal, yaitu
:
- Basa
membentuk ikatan dengan hidrogen
- Elektron-elektron C-H membentuk
ikatan pi
- Brom
bersama sepasang elektronnya meninggalkan ikatan sigma C-Br
Dalam reaksi E2, alkil halida tersier lebih cepat bereaksi sedangkan
alkil halida primer lebih lambat bereaksi.
Mekanisme Reaksi E2
Dalam reaksi E2, ikatan baru terbentuk antara
basa, H3CO-, dan proton dari 2-klorobutana, sementara secara bersamaan ikatan
karbon-klorin rusak dan ikatan pi baru sedang terbentuk pada butana. Anion
klorida yang pergi disebut sebagai kelompok yang meninggalkan.
Istilah E2 adalah singkatan dari reaksi
Eliminasi, orde kedua (juga disebut bimolekul). Menurut mekanisme E2, ada satu
keadaan transisi karena pemutusan ikatan dan pembuatan ikatan terjadi secara
bersamaan. Reaksi seperti reaksi E2 di mana atom hilang dari dua atom yang
berdekatan dari molekul diklasifikasikan di bawah kategori yang lebih luas dari
reaksi eliminasi beta. Dalam mekanisme E2 yang mengacu pada eliminasi bimolekuler
pada dasarnya adalah mekanisme satu langkah. Reaksi bimolecular, seperti
reaksi E2 adalah reaksi di mana dua reaktan mengambil bagian dalam keadaan
transisi dari reaksi yang lambat atau yang menentukan laju reaksi. Untuk alasan
ini, konsentrasi basa dan alkil halida baik sebanding dengan laju reaksi E2
yang diamati.
Pengaruh struktur alkil halida pada reaktivitas
Alkil halida sekunder seperti 2-chlorobutane dapat bereaksi dengan jalur reaksi
E2 atau SN2 ke berbagai tingkat tergantung pada sifat nukleofil atau basa yang
digunakan. Jika basa kuat seperti metoksida digunakan, langkah pemindahan
proton disukai dan mekanisme E2 menunjukkan kembali seperti yang ditunjukkan
pada gambar. Jika basa lemah atau nukleofil kuat digunakan seperti halida lain
atau anion azida (N3-) digunakan, maka substitusi menurut jalur reaksi SN2
lebih disukai.
Geometri anti-periplanar Untuk pemutusan ikatan
dan pembuatan ikatan terjadi dengan tumpang tindih orbital yang tepat dalam
reaksi E2, proton yang ditransfer harus ditempatkan dalam geometri
anti-periplanar (di sisi yang berlawanan) berkenaan dengan kelompok
meninggalkan klorida. Ini dapat dilihat pada gambar, reaksi dengan
memeriksa arah molekul basa yang mendekat dan lintasan anion klorida yang
pergi.
Permasalahan:
1. Mengapa
pada reaksi E2 hanya dipengaruhi oleh konsentrasi basa?
2. Dapat
sama-sama kita ketahui, bahwa didalam mekanisme reaksi eliminasi E2 ini tidak
terjadi pembentukan karbokation. Mengapa hal ini bisa terjadi?
3. Mengapa
dalam mekanisme E2 yang mengacu pada eliminasi bimolekuler pada dasarnya adalah
mekanisme satu langkah?


Hi Arsita, Saya Julia Krisnawati dengan NIM A1C119043 ingin mencoba menjawab pertanyaan nomor 2.
BalasHapusMenurut saya, bisa saja dalam mekanisme reaksi eliminasi E2 terjadi pembentukan karbokation. Misalnya penambahan senyawa lainnya yang dapat memicu terbentuknya karbokation atau cara-cara lainnya. Sehingga menurut saya, tidak semua mekanisme reaksi eliminasi tidak terjadi pembentukan karbokation.
Terimakasih
Hallo Arsita, Saya Shalsadilla NIM A1C119046 ingin mencoba menjawab permasalahan nomor 3
BalasHapusE2 merupakan singkatan dari eliminasi bimolekular. Reaksi tersebut melibatkan mekanisme satu-tahap di mana ikatan karbon-hidrogen dan karbon-halogen terputus untuk membentuk ikatan rangkap dua (ikatan pi C=C). dimana salah satu karakteristiknya adalah E2 merupakan eliminasi satu tahap, dengan satu keadaan transisi.
baiklah saya nadia fransiska dengan NIM A1C119034 akan mencoba menjawab pertanyaan nomor 1. pada reaksi E2 hanya di pengaruhi oleh konsentrasi basa tinggi itu karena basa yang di gunakan harus cukup kuat untuk melepas hidrogen yang kurang asam, dan pabila yang di gunakan untuk reaksi ini adalah basa lemah kemungkinan tidak akan terjadi pelepasan pada hidrogen yang kurang asam.
BalasHapus