MEKANISME REAKSI BERSAING SN2 dan E2
Reaksi SN2 dan E2 yaitu
dua reaksi substitusi dan eliminasi yang paling umum dan bermanfaat. Reaksi SN2
membutuhkan nukleofil yang baik, sedangkan reaksi E2 membutuhkan basa yang
baik. Namun dalam banyak kasus, nukleofil yang baik juga merupakan basa yang baik.
Jadi SN2 dan E2 sering bersaing dalam kondisi reaksi yang sama. Pemenang
ditentukan oleh derajat percabangan α dan β dan kekuatan nukleofil / basa.
Peningkatan percabangan α dan β dan kebasaan yang kuat mendukung eliminasi E2.
Peningkatan nukleofilisitas mendukung reaksi SN2.
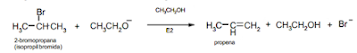
Reaksi SN2 juga bisa dikatakan substitusi nukleofilik Bimolekular. Dan reaksi
E2 yaitu reaksi yang terjadi apabila alkil halida direaksikan dengan basa kuat.
Tingkat kebasaan suatu nukleofil dapat mempengaruhi pada kompetisi reaksi SN2
dan E2Reaksi SN2 bisa juga terjadi apabila digunakannya pelarut yang lebih
polar. Reaksi SN2 dan E2 ini memiliki beberapa kesamaan diantaranya yaitu
keduanya menjalankan hanya melalui proses 1 tahap, yang mana menggunakan 2
molekul sekaligus pada 1 tahap, kedua reaksi tidak menghasilkan karbokation.
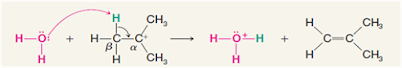
Pada gambar di bawah ini bisa kita lihat bahwasanya ada dua kemungkinan
kejadian yang akan terjadi, yaitu pada reaksi SN2 dan bisa saja pada reaksi E2.
Perlu kita lihat, kejadian pertama jika basa kuat menyerang atom H β pada C β
maka akan terbentuk ikatan rangkap pada C dan X lepas maka produk yang
dihasilkan adalah produk E2. Sedangkan jika nukleofil menyerang atom C dan X
lepas sebagai leaving group, maka produk yang dihasilkan adalah SN2.
Pada reaksi kompetisi SN2 dan E2 ini apabila pada reaksi bersaing SN2 dan E2
menggunakan alkil halida sekunder bisa juga bereaksi, karena mereka tidak
mengalami ionisasi menjadi ion karbonium atau membentuk karbokation. Tetapi
apabila menggunakan halida tersier yang berjalan dengan basa kuat dalam pelarut
kurang polar maka reaksi yang terjadi yaitu E2, tidak dengan SN2. Kemudian,
ketika menggunakan alkil halida primer maka yang terjadi adalah reaksi
substitusi, SN2. Mekanisme yang terjadi sangat dipengaruhi oleh keadaan reaksi.
Jika yang dipakai nukleofil basa lemah dengan pelarut polar aprotik, maka yang
lebih dominan adalah SN2. E2 akan dominan jika yang dipakai adalah basa kuat
seperti CH3CH2O-, atau OH- atau NH2-. Dan juga semakin tinggi temperatur,
produk E2 yang dihasilkan banyak.
Faktor- faktor yang bisa mempengaruhi reaksi bersain SN2 dan E2 adalah
temperatur, Struktur alkil halida (substrat), struktur basanya.
Permasalahan :
1.
Apa yang terjadi apabila pada reaksi
bersaing SN2 dan E2 menggunakan alkil halida sekunder? Bagaimana produk yang
dihasilkan?
2.
Mengapa tingkat kebasaan suatu nukleofil
dapat mempengaruhi pada kompetisi reaksi SN2 dan E2?
3.
Mengapa semakin tinggi temperatur,
produk E2 yang dihasilkan banyak juga?