Pembentukan Dan Sifat-Sifat
Asam Karboksilat
Asam karboksilat atau asam organik adalah senyawa
yang mengandung dalam molekul gugus fungsi karboksil yang melekat pada radikal
hidrokarbon. Mereka sebagian besar didistribusikan di alam dan merupakan zat
antara dalam jalur degradasi asam amino, lemak, dan karbohidrat. Gugus
karboksil terdiri dari karbonil (C = O) dengan gugus hidroksil (O – H) yang
terikat pada atom karbon yang sama dan biasanya ditulis sebagai –COOH atau
CO2H. Senyawa yang menyajikan dua atau lebih gugus karboksilat disebut asam
dikarboksilat, asam trikarboksilat, sedangkan garam dan esternya disebut
karboksilat. Dengan sifat radikal, mereka dapat diklasifikasikan menjadi asam
jenuh, tidak jenuh, atau aromatik. Dalam nomenklatur Internasional Ikatan Kimia
Murni dan Terapan Internasional, asam karboksilat memiliki akhiran “-oat asam”
yang ditambahkan ke hidrokarbon yang memiliki jumlah atom karbon yang sama.
Namun, beberapa asam organik disebut dengan nama umum mereka, misalnya, asam
format dan asam asetat. Berikut adalah rumus struktur dari gugus asam
karboksilat.
Sifat asam karboksilat
Karakteristik kimia utama dari asam karboksilat
adalah keasamannya. Mereka umumnya lebih asam dari senyawa organik lain yang
mengandung gugus hidroksil tetapi umumnya lebih lemah daripada asam mineral
yang dikenal (misalnya, asam klorida, HCl, asam sulfat, H2SO4, dll.).
a. Sifat fisik asam karboksilat
·
Asam karboksilat
hingga sembilan atom karbon adalah cairan tidak berwarna dengan bau yang tidak
sedap. Asam karboksilat yang mengandung lebih dari sembilan atom karbon adalah
zat padat tidak berwarna dan tidak berbau karena volatilitasnya yang rendah.
·
Titik didih asam
karboksilat lebih tinggi daripada aldehida, keton dan alkohol dari massa
molekul yang sebanding
·
Ikatan O-H dalam
asam karboksilat melekat pada gugus karbonil penarik elektron; oleh karena itu,
ikatan O-H dalam asam karboksilat lebih terpolarisasi dibandingkan dengan
kelompok alkohol O-H.
·
Karena atom
oksigen dari gugus karbonil adalah polar, ia dapat membentuk ikatan-H dengan
atom hidrogen O-H dari molekul lain. Ikatan hidrogen ini sangat kuat sehingga
tidak putus sepenuhnya bahkan dalam fase uap. Akibatnya, sebagian besar asam
karboksilat ada sebagai dimer dalam fase uap atau dalam pelarut aprotik.
·
Kelarutan dalam
air: Asam karboksilat yang mengandung hingga empat atom karbon larut dalam air
karena mereka membentuk ikatan H dengan air. Kelarutan berkurang dengan
meningkatnya jumlah atom karbon.
· Kelarutan dalam pelarut organik: Asam karboksilat larut dalam pelarut organik yang kurang polar seperti benzena, eter, alkohol, dll.
· b. Sifat kimia asam karboksilat
Asam karboksilat
adalah asam yang lebih kuat daripada alkohol karena basa konjugat (produk yang
tersisa setelah dihilangkannya hidrogen) dari asam karboksilat distabilkan oleh
resonansi.
Karena ion karboksilat distabilkan oleh resonansi,
lebih mudah bagi asam karboksilat untuk melepaskan proton untuk membentuk
ion karboksilat.
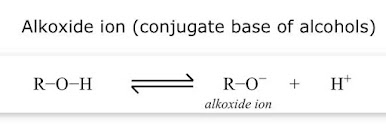
Ion alkoksida, di sisi lain, tidak menunjukkan
resonansi; oleh karena itu, ini kurang stabil.
Dengan kata lain, alkohol tidak melepaskan proton dengan mudah untuk membentuk
ion alkoksida yang kurang stabil; karena itu, alkohol kurang asam.
·
Karbon α milik
asam karboksilat dapat dengan mudah dihalogenasi melalui reaksi
Hell-Volhard-Zelinsky.
·
Senyawa ini
dapat diubah menjadi amina menggunakan reaksi Schmidt.
·
Asam alkanoat
merupakan asam lemah. Semakin banyak atom Cyang dimiliki, semakin lemah
asamnya. Asam alkanoat terkuatadalah asam metanoat.
Jika suatu asam alkanoat direaksikan dengan suatu
alkohol, dengan pengaruh asam sulfat pekat sebagai pengikat air, atom H dari
gugus COOH dapat diganti dengan gugus alkil sehingga terbentuk suatu ester.
Reaksi ini disebut dengan reaksi esterifikasi. Ester yangdihasilkan oleh reaksi
esterifikasi ini merupakan suatu non-elektrolit.
Permasalahan:
1. Salah satu sifat fisik asam karboksilat adalah titik didih asam karboksilat
lebih tinggi daripada aldehida, keton dan alkohol dari massa molekul yang
sebanding atau bobot molekul yang sama. Apa yang menyebabkan hal itu bisa
terjadi?
2. Jika suatu asam alkanoat direaksikan dengan suatu alkohol, dengan pengaruh
asam sulfat pekat (katalis asam) maka akan menghasilkan senyawa ester.
Bagaimana jika asam alkanoat ini direaksikan dengan suatu alkohol menggunakan
katalis basa?
3. Apa yang menyebabkan Asam karboksilat pada kelarutan dalam air akan
berkurang dengan meningkatnya jumlah atom karbon?